Большинство сигнальных соединений действует на специфические рецепторные белки в клетках-мишенях. Именно рецепторы обеспечивают возможность регуляторного действия сигнальных соединений в очень низких концентрациях (10-12-10-6 моль/л). Большинство клеток имеет рецепторы не к одному, а ко многим сигнальным соединениям. Например, в гепатоцитах выявлены рецепторы к инсулину, глюкагону, вазопрессину, гормону роста, пролактину, ряду цитокинов, факторов роста, простагландинам и т.д. Благодаря этому набору, обеспечивается координация функций одной клетки с состоянием других клеток и клеток других органов и систем.
Активация рецептора, как правило, приводит к изменению активности определенных белков и низкомолекулярных посредников (вторичных посредников), специфичных для каждой ткани.
Рецепторы гормонов представляют собой белки (иногда глико- или липопротеины), расположенные или в мембране клетки (мембранные рецепторы), или внутри клетки – (цитозольные и ядерные), или же могут быть встроены в мембраны эндоплазматической сети (например, рецепторы инозитолтрифосфата). 50 % рецепторов находятся на поверхности клеточной мембраны, остальные – внутри клетки.
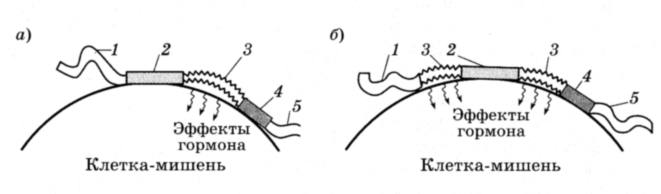
В молекуле гормонов можно выделить адресный участок или гаптон, который отвечает за прикрепление молекулы гормона к рецептору, и актон, который оказывает влияние на функции клетки-мишени (рисунок 1).
Рисунок 1 – Схема строения рецептора и активных участков в гормоне
(по В.А.Дубынину и др., 2003)
а) – актон в одном участке молекулы гормона;
б) – актон в двух участках молекулы гормона;
1 и 5 – защитные участки; 2 – гаптон; 3 – актон; 4 – усилитель
На поверхности клетки (в клеточной мембране) находятся рецепторы к белковым гормонам – ТТГ, СТГ, гастрину, пролактину, инсулину, инсулиноподобному фактору роста, соматомединам, кальцитонину, энкефалинам, эндорфинам, а также к катехоламинам, простагландинам, серотонину, гистамину и т. д. Внутри клетки находятся рецепторы к стероидным гормонам – глюкокортикоидам, минералокортикоидам, эстрогенам, андрогенам, прогестинам и т. д., а также к тиреоидным гормонам. К некоторым гормонам рецепторы еще не выявлены.
Рецепторы обладают высоким сродством и избирательностью (специфичностью) к гормонам. В одной и той же клетке могут быть десятки разных типов рецепторов. Их количество меняется в зависимости от уровня гормонов и регуляции их синтеза, в результате чего изменяется и степень воздействия гормонов на клетки-мишени. Характеристиками рецептора являются его специфичность, а также сродство (высокое или низкое). Сродство – это способность рецепторов данной структуры насыщаться гормоном. Эти характеристики сходны с таковыми у ферментов при описании ферментативной кинетики. Чем ниже сродство, тем быстрее происходят процессы ассоциации и диссоциации сигнальной молекулы с рецептором. Так, ассоциация нейромедиаторов может происходить за доли секунды, а для насыщения рецептора стероидными гормонами требуется несколько минут.
Связывание лиганда с рецептором приводит к изменениям конформации последнего, в результате чего меняется его способность взаимодействовать с эффекторными молекулами системы проведения сигнала или меняется ферментативная активность самого рецептора.
Некоторые рецепторы после взаимодействия с лигандом олигомеризуются, в результате чего может, например, происходить сближение фермента (внутриклеточного домена одной субъединицы рецептора) с субстратом (внутриклеточным доменом другой субъединицы рецептора).
Десенситизация, то есть снижение активности рецептора, как механизм самоограничения развития эффектов может происходить, например, путем кластеризации (образование скоплений), последующей интернализации (захвата внутрь клетки) и частичной или полной деградации с помощью систем протеолиза.
Максимальный биологический эффект, как правило, наблюдается в том случае, когда концентрация гормона обеспечивает связывание примерно с 5-10 % специфических участков связывания на рецепторах. Если же количество гормона слишком мало или слишком велико, активность рецепторов может меняться.
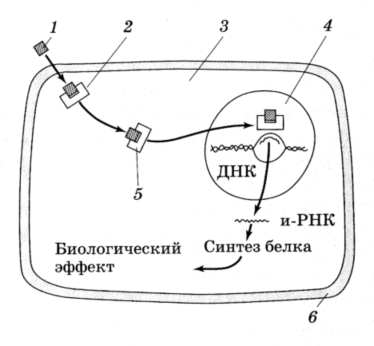
Механизмы действия стероидных и тиреоидных гормонов. Ядерные рецепторы. Это белки-рецепторы стероидных гормонов, ретиноидов, тиреоидных гормонов и витамина D3. Каждый рецептор имеет участок связывания лиганда и участок, взаимодействующий с соответствующим фрагментом ДНК, то есть ядерный рецептор представляет собой фактор транскрипции, активируемый лигандом (рисунок 2).
Рисунок 2 – Схема действия стероидных и тиреоидных гормонов на клетку
((по В.А.Дубынину и др., 2003)
1 – гормон, 2 – рецептор, 3 – клетка, 4 – ядро,
5 – комплекс гормон-рецептор, 6 – клеточная мембрана
Рецепторы для липофильных гормонов называются ядерными гормональными рецепторами, потому что они находятся в ядре и в результате их взаимодействия с гормоном активируется генетическая транскрипция (образуется мРНК). Образовавшаяся мРНК способствует синтезу специфических белков-ферментов, которые изменяют метаболизм в клетке-мишени. Рецептор активируется путем связывания со специфическим гормоном, после чего он может связаться со специфической областью в ДНК – т.наз. гормон-чувствительный элемент. Он представляет собой короткий фрагмент ДНК, содержащий характерные нуклеотидные основания, располагающиеся рядом с транскрибируемым геном. Ядерные гормональные рецепторы составляют два основных вида или группы – стероидная группа и тироидная группа. Стероидная группа содержит в рецепторном участке два одинаковых участка – гомодимер. Тироидная группа представляет собой гетеродимер и, кроме рецепторов к тироидным гормонам, содержит также рецепторы к активной форме витамина Д и к ретиноевой кислоте (образующейся из витамина А). Витамин Д и ретиноевая кислота, как и стероиды и тиреоидные гормоны, являются липофильными молекулами, которые играют важную роль в регуляции клеточных функций и физиологии органов.
Если цитоплазматический рецептор связывается с гормоном в цитоплазме, затем он переносится (транслоцируется) в ядро, где он связывается со специфическим гормональным доменом ДНК. Этот домен состоит из 2 частей, каждая из которых содержит 6 нуклеотидных оснований, разделенных на сегменты по 3 нуклеотида. 1 стероидный рецептор, связанный с 1 молекулой гормона, присоединяется к одному трехнуклеотидному фрагменту. К другому фрагменту присоединяется второй рецептор со второй молекулой гормона и дальше они действуют вместе – так называемая гомодимер. Только после димеризации активированный ядерный рецептор стимулирует транскрипцию отдельных генов, происходит трансляция РНК и увеличивается синтез белка 5-6 ферментов.
В отличие от стероидных гормонов, неактивный рецептор для Т3 находится в ядре. Т3 переносится в ядро с помощью каких-то неспецифических связывающих белков, где он связывается с лиганд-связывающим доменом рецептора, и только после этого ДНК-связывающий домен может присоединяться к ДНК-гормон-чувствительному фрагменту. В отличие от стероидных рецепторов, тиреоидные рецепторы являются гетеродимерами. Другая его половина является рецептором не для Т3, а для производного витамина А. Оба лиганда должны присоединиться к двум частям рецептора, и только после этого он может присоединиться к ДНК, стимулировать транскрипцию генов, образование специфической мРНК и, соответственно, синтез соответствующих ферментов. 10-12 белков-ферментов, участвующих в метаболизме и процессах энергообразования.
Механизмы действия белковых гормонов и биогенных аминов. Все эти гормоны не проникают через клеточные мембраны, поэтому для реализации своих эффектов используют так называемые вторые посредники (первыми посредниками обычно называют сами гормоны, т.к. они являются переносчиками сигналов от желез внутренней секреции к клеткам). Вторые посредники – это вещества, передающие информацию внутри клетки от клеточной мембраны к органеллам клетки. После того, как эти гормоны свяжутся с мембранными рецепторными белками, эти белки активируют специфические белки в плазматической мембране, в результате чего выделяются вторые посредники. Мембранные рецепторы подразделяют на каталитические, связанные с ионными каналами, являющиеся ионными каналами, действующие через G-белки и освобождающие факторы транскрипции.
Небольшое число молекул гормона, связываясь с рецепторами, вызывает образование гораздо большего числа молекул вторых посредников, которые в свою очередь влияют на активность еще большего числа молекул белков, то есть происходит амплификация сигнала.
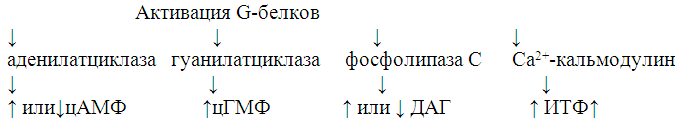
К вторым посредникам относят цАМФ и цГМФ, инозитолтрифосфат (ИТФ), диацилглицерол, Са2+, продукты окисления арахидоновой кислоты и некоторые другие (рисунок 3). В любом случае лиганды действуют прежде всего на G-белки, активируя его, а конечным этапом каскада реакций с участием вторых посредников является активация протеинкиназ.
Рисунок 3 – Механизм действия вторых посредников
Система второго посредника цАМФ-аденилатциклаза. цАМФ был первым «вторым посредником», который открыли в 60-е г.г. ХХ в. В результате соединения гормона с рецептором, который представляет собой т.наз. G-белок (ГТФ-активируемый белок), происходит диссоциация субъединицы из G-белкового комплекса. Эта субъединица активирует аденилатциклазу, в результате чего активируется реакция распада АТФ до цАМФ и пирофосфата. Увеличение концентрации цАМФ в цитоплазме ведет к активации протеинкиназы. Активная протеинкиназа катализирует фосфорилирование различных белков в клетках-мишенях. В результате этого одни белки активируются, а другие инактивируются. Таким образом цАМФ модулирует активность белков, которые уже находятся в клетке, в результате чего меняется метаболизм в клетке-мишени в ответ на действие гормона.
Связывание некоторых гормонов с соответствующим рецептором может приводить не к активации, а к угнетению аденилатциклазы и таким образом к уменьшению образования цАМФ.
Система второго посредника цГМФ-гуанилатциклаза включает в себя через G-белок гуанилатциклазу с последующим образованием цГМФ. Данная система, очевидно, играет важную роль в происходящей под действием света гиперполяризации мембран палочек в сетчатке глаза, в механизмах действия натрийуретического пептида.
Система второго посредника фосфолипаза С – Са2+ – инозитолтрифосфат. В ней также эффект стимуляции рецептора переносится на ГТФ-активируемый G-белок на внутренней поверхности мембраны. Затем мембранный липид фосфатидилинозитол превращается в фосфатидилинозитолдифосфат, который расщепляется на инозитолтрифосфат (ИТФ) и диацилглицерол. Мембрана эндоплазматического ретикулума содержит рецепторы для ИТФ, активация которых вызывает открытие Са2+-каналов, вследствие чего Са2+ диффундирует из эндоплазматического ретикулума в цитоплазму и вызывает резкий и быстрый подъем концентрации Са2+ в цитоплазме. В цитоплазме Са2+ связывается с белком калмодулином, который, в свою очередь, активирует специфическую протеинкиназу (которые фосфорилируют белки), в результате чего меняется активность определенных ферментов. Диацилглицерол активирует С-киназу, которая запускает фосфорилирование белков, переводя их в активную форму.
Кальций является важным компонентом системы вторых посредников. Он может проникать в клетку через специфические мембранные каналы, когда они находятся в открытом состоянии, например, при изменении мембранного потенциала. Возникающее в результате повышение концентрации Са2+ запускает важные реакции в клетке, такие, как сокращение миофибрилл, которое является основой мышечного сокращения, или выделение везикул, содержащих медиаторы, из нервных окончаний. Са2+, оказывающий регуляторное действие, может высвобождаться также и из внутриклеточных депо, таких, как эндоплазматический ретикулум. Концентрация Са2+ в цитоплазме в норме поддерживается на очень низком уровне (в 10 тысяч раз меньше, чем во внеклеточной жидкости) посредством переносчиков активного транспорта – кальциевого насоса – в плазматической мембране. Очень низкий уровень Са2+ в цитоплазме способствует тому, что различные стимулы могут вызывать очень краткие и быстрые потоки Са2+ в цитоплазму, что служит сигналом к активации различных контролирующих систем. Например, на терминалях аксонов вход Са2+ по электрорегулируемым Са-каналам в плазматическую мембрану служит сигналом для выделения нейромедиаторов. Таким же образом стимулируется мышечное сокращение: начальным сигналом является вход Са2+ в цитоплазму мышечного волокна.