ЛАБОРАТОРНАЯ работа №26
Определение активности НАДФ–ЗАВИСИМОЙ МАЛАТДЕГИДРОГЕНАЗЫ
НАД–зависимая малатдегидрогеназа (НАД – МДГ) (L–малат: НАД–оксидоредуктаза; КФ 1.1.1.37) катализирует реакцию окисления яблочной кислоты до щавелевоуксусной: малат + НАД + ↔ оксалоацетат + НАДН + Н+
Реакция обратима.
Фермент локализован как в митохондриальной, так и в цитоплазматической фракциях клеток. Как митохондриальная, так и цитоплазматическая формы НАД – МДГ отличаются по свойствам. Митохондриальная НАД – МДГ имеет более низкую молекулярную массу: 62 – 65кДа, цитоплазматическая – около 72 кДа. Обе изоформы фермента состоят из 2 субъединиц.
Отличительной особенностью митохондриальной НАД – МДГ от цитоплазматической формы фермента является субстратное ингибирование его при восстановлении оксалоацетата. Зависимость скорости восстановления кетокислоты от ее концентрации имеет четкий оптимум 0,9 – 1,0∙10 –4 М. В то же время по мере роста концентрации малата, наблюдается субстратная активация фермента из митохондрий. По стереоспецифичности мМДГ относится к дегидрогеназам типа А.
Механизм действия фермента последовательный, принудительно упорядоченный без кинетически значимых тройных комплексов в обеих направлениях реакции. Первым к энзиму присоединяется кофермент, затем субстрат с немедленным образованием и отделением продукта. Последним этапом, который лимитирует скорость всей реакции, является отщепление кофермента.
При электрофорезе обе изоформы НАД – МДГ дают несколько полос с малатдегидрогеназной активностью; количество и соотношение их различно в разных тканях и изменяется при различных воздействиях на организм.
Роль НАД – зависимой малатдегидрогеназы в животных тканях полифункциональна.
Митохондриальная изоформа энзима, катализируя один из этапов ЦТК, участвует в поддержании энергетического баланса, поставляя востановленную форму пиридиннуклеотида в дыхательную цепь митохондрий. Вторая важная функция системы из митохондриальной и цитоплазматической форм НАД – МДГ – участие в начальных этапах глюконеогенеза, которая выражается в обеспечении субстратом фосфоенолпируваткарбоксилазной реакции. Еще одна роль малатдегидрогеназы – участие фермента в переносе восстановительных эквивалентов через митохондриальную мембрану. Осуществление этой функции возможно благодаря высокой активности обеих изоформ фермента и эффективному транспорту малата через мембрану митохондрий. Функционирование «малатного челнока» является одним из основных механизмов, регулирующих соотношене окисленных и восстановленных форм НАД в митохондриальном и цитозольном компартментах клетки. Соотношение между степенью восстановленности пиридиновых нуклеотидов и концентрацией ЩУК контролирует скорость лимитирующего этапа ЦТК – цитратсинтазную реакцию.
Исходя из вышесказанного, изучение НАД – МДГ реакций в различных компартментах клетки представляет значительный интерес.
Задание 1. Определение активности НАД – зависимой малатдегидрогеназы (прямая реакция)
Принцип метода. Определение активности НАД – МДГ в субклеточных фракциях проводят, используя прямую малатдегидрогеназную реакцию, в которой количество окисленного малата эквимолярно количеству восстановленного пиридиннуклеотида. Спектры поглощения восстановленной и окисленной форм пиридиновых нуклеотидов существенно отличаются: спектр поглощения НАД+ имеет максимум при длине волны 260 нм, спектр поглощения НАДН–при 340 нм. Таким образом, метод сводится к количественному определению образовавшегося восстановленного никотинамидадениндинуклеотида. Для этого регистрируют изменение оптической плотности реакционной смеси при 340 нм. Проведение энзиматической реакции в щелочной среде способствует сдвигу равновесия в сторону окисления яблочной кислоты.
Реактивы:
|
1. Na–глициновый буфер 2. D, L–малат 3. НАД |
–85 мМ, рН 10,0 –85 мМ –25 мМ . |
4. 0,1 % раствор детергента тритона Х – 100 (готовят перед использованием, разводя средой выделения субклеточных фракций более концентрированный (1%–й) раствор детергента, хранящийся в холодильнике).
5. Среда для выделения субклеточных фракций – 0,25 Мраствор сахарозы, содержащей 1 мМЭДТА (рН 7,4); возможно использование и других сред выделения; реактив готовят накануне эксперимента и хранят в холодильнике.
Оборудование: Спектрофотометр СФ – 46 (ЛОМО), автоматические пипетки объемом 10 –100 мкл и 200 –1000 мкл, пробирки, спектрофотометрические кюветы, весы аналитические
Ход работы
Выделение субклеточных фракций (митохондриальной и цитоплазматической) проводят методом дифференциального центрифугирования. После выделения и отмывки осадок митохондрий ресуспендировали в среде выделения из расчета 1 мл среды на осадок митохондрий, выделенный из1 гткани.
Суспензию митохондрий обрабатывают детергентом «Тритон Х – 100», добавляя 0,1 %–й р–р из расчета 2 мл на осадок митохондрий, выделенный из1 гткани. Пробу оставляют на 30 мин во льду.
Перед спектрофотометрированием суспензию митохондрий разводят и для анализа активности цитоплазматической формы НАД – МДГ использовали надосадочную жидкость, которую также разводили. Степень разведения определялась активностью фермента в исследуемой ткани и устанавливалась опытным путем в предварительном эксперименте.
Для проведения энзиматической реакции в кювету спектрофотометра вносят 2,9 мл среды инкубации:
1. Na–глициновый буфер , рН 10,0 – 1,0 мл
2. D, L–малат натрия – 1,0 мл
3. НАД – 0,1 мл
4. Н2О – 0,8 мл
____________________________________________
2,9 мл
Реакцию начинают добавлением 0,1 мл тканевого препарата (разведенная суспензия митохондрий или надосадочная жидкость).
Оптическую плотность измеряют при длине волны 340 нм, считывая показания через 1 мин в течение 3 – 5 мин.
Активность фермента рассчитывают по формуле:
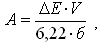
где ∆ Е изменение оптической плотности пробы за 1 минуту;
V – конечный объем пробы в кювете (3,0 мл);
6,22 – коэффицент миллимолярной экстинкции восстанов ленной формы пиридиннуклеотидов при длине волны равной 340 нм;
б – количество белка в пробе (в мг), определенное параллельно в том же тканевом препарате по методу Лоури.
Задание 2. Определение активности НАД – зависимой малатдегидрогеназы (обратная реакция)
Принцип метода. НАД – МДГ катализирует реакцию:
L–малат + НАД+ ↔ оксалоацетат + НАДН + Н+,
равновесие которой при нейтральном значении рН сдвинуто влево. Об активности фермента судят по изменению количества восстановленной формы пиридиннуклеотида, которое эквимолярно количеству оксалоацетата, использованного в реакции.
Т.к. оксалоацетат в водном растворе нестабилен и может частично превращается в пируват, его готовят непосредственно перед внесением в кювету.
Реактивы: 0,15 М фосфатный буфер рН 7,4; 0,006 М НАДН, взвесь митохондрий, 0,01 М оксалоацетат.
Оборудование: Спектрофотометр СФ – 46 (ЛОМО), автоматические пипетки объемом 10 – 100 мкл и 200 –1000 мкл, пробирки, спектрофотометрические кюветы, весы аналитические
Ход работы
Инкубационная среда для определения активности НАД – МДГ содержит следующие компоненты:
|
1. 0,15 Мфосфатный буфер рН 7,4 2. 0,006 МНАДН 3. Взвесь митохондрий |
– 2,5 – 0,2 – 0,2 |
Суспензию митохондрий готовят из расчета 1 мл0,25 Мсахарозы на осадок митохондрий из1 гткани и непосредственно используют.
Пробирки, содержащие инкубационную смесь, преинкубируют 20 мин при температуре 250С. затем содержимое переносят в кювету и измеряют исходную величину оптической плотности Е1. Реакцию начинают внесением 0,1 мл 0,01 М оксалоацетата. Изменение величины оптической плотности регистрируют по уменьшению оптической плотности через 1 мин в течение 3 – 5 мин. Активность фермента рассчитывают в наномолях НАД ∙ мин–1∙мг–1 белка по формуле:
 ,
,
где, ∆ Е – изменение оптической плотности пробы за 1мин
(∆ Е=Е1–Е2)/время;
V – объем пробы в кювете (3 мл);
6,22 – коэффициент миллимолярной экстинции НАДН при длине волны 340 нм;
1000 – коэффициент перевода микромолей в наномоли;
б – содержание белка в исследуемой пробе, мг.
