ЛАБОРАТОРНАЯ работа №23
Определение активности НАДФ-ЗАВИСИМОЙ
ИЗОЦИТРАТДЕГИДРОГЕНАЗЫ
НАДФ-зависимая изоцитратдегидрогеназа (НАДФ-ИДГ) (изоцитрат: НАДФ-оксидоредуктаза декарбоксилирующая, КФ 1.1.1.42) катализирует обратимую реакцию окислительного декарбоксилирования изолимонной кислоты, в ходе которой образуется α-кетоглутарат, СО2 и восстановленная форма НАДФ – НАДФН:
изоцитрат + НАДФ ↔ α-кетоглутарат + СО2 + НАДФН + Н+
Константа равновесия реакции, катализируемой НАДФ-ИДГ в среднем равна 1, но в физиологических условиях равновесие в большинстве случаев сдвинуто в сторону образования кетокислоты.
Молекулярная масса мНАДФ ИДГ 58 кДа, фермент состоит из одной полипептидной цепи. Молекулярная масса цитНАДФ ИДГ выше, чем у митохондриальной, она равна, по данным разных авторов, от 75 до 96 кДа. Фермент состоит из 2 субъединиц. Фермент локализован как в митохондриальной, так и цитоплазматической фракциях клеток. У взрослых животных в органах с активно протекающими биосинтетическими процессами (печень, жировая ткань) значительная часть (70 – 80 %) активности НАДФ-ИДГ сосредоточена во внемитохондриальной фракции. В головном мозгу новорожденных животных в период интенсивной миелинизации, которая характеризуется активными биосинтетическими процессами, значительная часть изоцитрата окисляется с помощью НАДФ-ИДГ, локализованной в цитоплазме. В ходе постнатального развития животного активность НАДФ-ИДГ в цитоплазме клеток мозга уменьшается и достигает значений, как у взрослых особей.
В митохондриях печени около 8 – 10% от общего содержания изоцитрата подвергается окислительному превращению с помощью НАДФ-зависимой изоцитратдегидрогеназы. Для протекания НАДФ-ИДГ реакции необходимы ионы Mg ++ или Mn++, поскольку истинным субстратом реакции является комплекс двухвалентного катиона с недиссоциированным изоцитратом (в отличие от НАД-ИДГ, где активной формой является изоцитрат–-). Активность фермента обусловлена наличием сульфгидрильных групп, причем, из 5 SH-групп только 2 связаны с активностью фермента, одна из них находится в активном центре, а другая необходима для поддержания активной конформации фермента.НАДФ-зависимая ИДГ ингибируется НАДН, АТФ и высокими концентрациями НАДФН.
Принцип метода. В процессе окислительного превращения изолимонной кислоты до α-кетоглутаровой происходит восстановление НАДФ; количество восстановленного НАДФ эквимолярно количеству окисленого изоцитрата.
Изменение содержания НАДФН регистрируется на спектрофотометре при длине волны 340 нм.
Реактивы:
1. 0,1 Мтрис-НСl-буфер, рН 7,4.
2. 0,02 МMnCl2 ∙ 4 H2O.
3. 0,003 МНАДФ
4. 0,08 Мр-р D,L-изоцитрат Na.
Оборудование: Спектрофотометр СФ-46 (ЛОМО), автоматические пипетки объемом 10-100 мкл и 200-1000 мкл, пробирки, спектрофотометрические кюветы, весы аналитические
Ход работы
Навески НАДФ и изоцитрата растворяют перед приготовлением инкубационной среды. В пробу вносят компоненты инкубационной среды, которые заранее смешивают в указанных пропорциях в объеме, зависящем от количества проб.
|
1. трис-НСl 2. Mn++ 3. НАДФ 4. D,L-изоцитрат 5. H2O |
- 1,5 мл - 0,5 мл - 0,5 мл - 0,1 - 0,3 мл |
В кювету вносят по 2,9 мл готовой инкубационной среды, затем, не вынимая кювету из прибора, добавляют 0,1 мл суспензии митохондрий или цитоплазмы, перемешивают. Реакцию начинают внесением препарата, содержащего фермент (0,1 млцитоплазмы либо суспензии митохондрий).
Изменение оптической плотности раствора в результате восстановления НАДФ регистрируют в течение 3 - 5 мин с интервалом в 1 мин
Активность фермента рассчитывают по формуле:
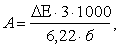
где ∆ Е – изменение оптической плотности за 1 мин;
3 – объем исследуемой пробы;
1000 – коэффициент перевода микромолей в наномоли;
б – содержание белка в исследуемом образце, мг;
6,22 – коэффициент микромолярной экстинкции НАДФН (мМ-1 см-1).
