ЛАБОРАТОРНАЯ работа №25
Определение активности СУКЦИНАТДЕГИДРОГЕНАЗЫ
Сукцинатдегидрогеназа (СДГ) (сукцинат: (акцептор) – оксидоредуктаза, КФ 1.3.99,1) катализирует реакцию дегидрирования сукцината в фумарат. Она является высокоспецифичным ферментом, окисляющим кроме сукцината только монометил-, моноэтил- и монохлорсукцинат. Естественным акцептором электронов в реакции окисления сукцината является цитохромная система, передающая их на кислород, что в конечном счете приводит к образованию фумарата и воды.
Молекулярная масса энзима около 200 кДа, в состав молекулы входит 1 моль флавина, негеминовое железо и кислотолабильный сульфид. В составе СДГ установлено наличие двух субъединиц с молекулярной массой 27 и 69 кДа. СДГ локализована во внутренней мембране митохондрий и входит в состав II комплекса цепи переноса электронов. СДГ является сложным белком, в качестве простетической группы выступает ФАД. В составе апоферментного белка присутствуют Fe-S-центры, которые играют важную роль в осуществлении каталитического акта.
СДГ обладает высокой скоростью окисления янтарной кислоты. Конкурентными ингибиторами энзима являются аналоги субстрата – фумарат, малонат, ЩУК.
Определение активности этого фермента широко применяется в биохимических, биологических и др. исследованиях. Для определения активности энзима используют различные методы. Нами использован метод определения активности СДГ, в котором в качестве конечного акцептора электронов используется феррицианид калия.
Принцип метода. Под действием СДГ сукцинат восстанавливает феррицианид калия (К3[Fe(CN)6]), раствор которого имеет желтую окраску, до бесцветного ферроцианида калия (К4[Fe(CN)6]). Активность фермента пропорциональна количеству восстановленного феррицианида.
Схема реакции:
сукцинат + 2[Fe(CN)6]3- -СДГ ® фумарат + 2[Fe(CN)6]4- +2Н+
Реактивы:
- 0,1 Мфосфатный буфер, рН 7,8;
- 0,1 Мянтарная кислота, рН 7,8;
- 25 мМК3[Fe(CN)6];
- 150 мМазид натрия (необходимо соблюдать все меры предосторожности, принятые при работе с ядами);
- 25 мМЭДТА, рН 7,8;
- 20 % раствор ТХУ.
В работе используется либо гомогенат ткани (1: 10) в 0,1 Мфосфатном буфере или среде выделения митохондрий, либо суспензия митохондрий. Разведение подбирается в предварительном эксперименте.
Оборудование: Спектрофотометр СФ-46 (ЛОМО), автоматические пипетки объемом 10 – 100 мкл и 200 – 1000 мкл, пробирки, спектрофотометрические кюветы, весы аналитические
Ход работы
В пробирки вносят инкубационную смесь следующего состава:
- 0,1 МКалий–фосфатный буфер, рН 7,8 – 1 мл
- 0,1 Мянтарная кислота, рН 7,8 – 0.1 мл
- 25 мМЭДТА, рН 7,8 – 0,1 мл
- 150 мМазид Na – 0,1 мл
- Н2О – 0,1 мл
– 1.4 мл
В пробы вносят по 0,5 мл суспензии митохондрий, либо гомогената ткани. Образцы инкубируют при комнатной температуре в течение 5 мин для ингибирования цитохромоксидазы азидом натрия.
Реакцию начинают прибавлением к пробам 0,1 мл раствора феррицианида калия, пробы инкубируют в течение 15 мин. при температуре 300С.
После инкубации реакцию останавливают добавлением к пробам 2.0 мл 20 % ТХУ. В контрольные пробы, содержащие все компоненты инкубационной смеси, ТХУ добавляется перед внесением суспензии митохондрий либо гомогената. В контрольных пробах сукцинатдегидрогеназа с начала инкубации полностью денатурирована и специфического восстановления феррицианида сукцинатом не происходит.
После остановки реакции пробы центрифугируют при 2000 об/мин в течение 15 мин для осаждения денатурированного митохондриального белка. Прозрачную надосадочную жидкость фотометрируют на спектрофотометре при 420 нм. Оптическим контролем служит смесь 20 % ТХУ и0,1 Мфосфатного буфера в соотношении 1:1.
Для определения содержания феррицианида в пробах по результатам фотометрирования проб, содержащих от 100 до 1000 мкг феррицианида в 4 мл раствора строят калибровочную кривую. По разности экстинкций (Ек – Ео) рассчитывают количество феррицианида, восстановленного за время инкубации.
Поскольку реакция протекает стехиометрически и 1 моль сукцината восстанавливает 2 моля феррицианида, можно выражать активность СДГ количеством окисленного сукцината.
Активность фермента (в нмоль сукцината / мг белка за 1 мин) вычисляется по формуле:
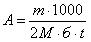
где m – количество восстановленного феррицианида (в мкг);
М– молекулярная масса феррицианида калия;
б – содержание белка в пробе в мг;
t – время инкубации в мин.
