БЕЛКИ
Белки, или протеины (в переводе с греческого означает «первые» или «важнейшие»), присутствуют во всех клетках. На их долю у животных приходится около половины сухой массы, у растений – 20–35 %. В белках массовая доля углерода в среднем составляет ~ 50 %, водорода ~ 7 %, кислорода ~ 23 %, азота ~ 16 %, серы ~ 1–3 %. В их составе также встречаются и другие химические элементы.
Белки – наиболее многочисленные и исключительно многообразные по функциям макромолекулы, играющие фундаментальную роль в формировании и поддержании структуры и функций живых организмов. С белками в живом организме связаны такие биологические процессы, как рост, деление, размножение и развитие клеток, реализация наследственной информации, мышечные сокращения, нервная деятельность, обмен веществ и т.д.
Белки – это высокомолекулярные биополимеры, структурную основу которых составляют полипептидные цепи, состоящие из аминокислотных остатков, связанных друг с другом пептидной связью. При их гидролизе образуются аминокислоты. В составе белков встречаются двадцать стандартных аминокислот. Для каждой стандартной аминокислоты существует генетический код, при помощи которого в генах записана информация о кодируемом белке. Кроме двадцати стандартных аминокислот, в составе белка встречаются и другие аминокислоты, они образуются в результате модификации стандартных аминокислот, после того как последние были включены в состав молекулы белка. Например, в составе белка коллагена содержится 5-гидроксилизин, который образуется в результате модификации стандартной аминокислоты лизина:
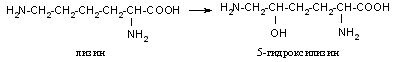
Кроме аминокислотных остатков, в состав белков могут входить и другие компоненты: ионы металлов, углеводы, липиды, нуклеиновые кислоты и др. Многообразие белков определяется не только их качественным составом, но и числом аминокислотных остатков, и прежде всего порядком их чередования в молекуле. Потенциально разнообразие белков безгранично.
Между аминокислотными остатками в молекуле белка существуют различные химические взаимодействия, это – ковалентные, ионные, водородные связи, гидрофобные взаимодействия, ван-дер-ваальсовы силы.
Отмеченные выше химические связи и взаимодействия принимают участие в формировании структуры белковых молекул. Благодаря пептидным связям образуются полипептидные цепи и, таким образом, формируется первичная структура белка. Пространственная организация белковой молекулы определяется в основном водородными, ионными связями, ван-дер-ваальсовыми силами, гидрофобными взаимодействиями. Водородные связи, возникающие между пептидными группами, определяют вторичную структуру белка. Формирование третичной и четвертичной структуры осуществляется водородными связями, образующимися между радикалами полярных аминокислот, ионными связями, ван-дер-ваальсовыми силами, гидрофобными взаимодействиями. Дисульфидные связи принимают участие в стабилизации третичной структуры.
Белки выполняют разнообразные функции. В связи с этим среди них различают структурные, питательные, запасные, сократительные, транспортные, каталитические, защитные, рецепторные, регуляторные и др. белки.