Лабораторная работа №10
ИЗУЧЕНИЕ ВЗАИМОДЕЙСТВИЯ ГЕМОГЛОБИНА С
КИСЛОРОДОМ. ГРАФИК ХИЛЛА
Гемоглобин выполняет в организме важнейшую функцию по транспорту дыхательных газов: кислорода, углекислого газа. Изоэлектрическая точка гемоглобина 6.8, гемоглобин определяет анионный и катионный состав цитоплазмы эритроцитов, ее буферные свойства. Гемоглобин называют атомом водорода биохимии (Perutz M.Z. 1987), настолько фундаментальными представляются принципы его функционирования: аллостерическое переключение между двумя структурными состояниями белка с различной активностью, образование транспортируемым лигандом (молекулой кислорода) координационного комплекса с ионом металла (ионом железа) и использование его переходов между высокоспиновым и низкоспиновым состояниями для эффективного транспорта кислорода, последовательное связывание лигандов (молекул кислорода), изолирование ионов железа в карманах структуры глобина (белковой части молекулы гемоглобина), использование сопряженных группировок молекулы белка со значениями рК в физиологической области для повышения чувствительности к небольшим изменениям рН. Все это позволяет гемоглобину тонко регулировать кислородный гомеостаз организма. Молекулярная масса гемоглобина 64500 Д, он представляет тетрамер, состоит из двух α- субединиц, содержащих 141 аминокислотный остаток, и двух β- субединиц, содержащих 146 аминокислотных остатков. Каждая аминокислотная цепь состоит из нескольких спиральных сегментов и содержит по одной молекуле гема – ферропротопорфирина. Образование тетрамерной молекулы гемоглобина резко ограничивает подвижность и изменяет конформацию отдельных полипептидных цепей в ансамбле молекулы белка.
Белковая глобула гемоглобина осуществляет передачу информации о состоянии эритроцита, и всего организма, к центрам связывания кислорода (ионам железа Fe (II) гема), лигандирует и защищает порфириновые кольца. Регулирование процессов взаимодействия гемоглобина с кислородом и его транспорта осуществляется на нескольких уровнях: атомарном (специфическое лигандирование иона железа в порфирине), молекулярном (молекула гемоглобина контролирует О2 – связывающий центр), клеточном (эритроцит обеспечивает длительное циркулирование гемоглобина в крови и повышает концентрацию регуляторов). Полость, в которой локализован порфирин (гем), образована жесткими стабильными α-спиралями. Ионы железа в гемах координированы четырьмя атомами азота порфирина и атомам азота гистидина молекулы белка, который называется проксимальным. Шестое координационное аксиальное место иона железа гема заполняется молекулой О2. Гем находится также в Ван-дер-Вальсовом контакте с еще одним остатком гистидина молекулы белка с дистальной стороны.
Связывание кислорода с гемоглобином представляет кооперативный процесс, в гемоглобинах позвоночных кооперативное связывание кислорода определяется равновесием между двумя различными структурами молекулы гемоглобина, окси-формой (или R-relax) и дезокси-формой ( или T-tense). Равновесие между этими формами определяется уравнением:
La=[T] / [R]
Стереохимия процесса взаимодействия О2 с гемоглобином известна, в основном, благодаря кристаллографическим работам Перутца (1969, 1970).
Гемоглобин представляет редкий пример, когда удалось проследить сложный путь от пускового механизма, каковыми является изменение состояния иона железа гема, до движения субъединиц молекулы гемоглобина, и связывания молекулы кислорода. Неравновесные функционально важные движения молекулы гемоглобина, каковыми являются переключения между двумя состояниями R → Т, лежат в основе процесса связывания кислорода.
Следует отметить, ион железа гема в гемоглобине обеспечивает обратимое связывание молекулярного кислорода, в цитохромах – перенос электронов, одни и те же химические структуры способны выполнять в биологических системах различные функции. Гемоглобин представляет пример аллостерического белка. График зависимости насыщения гемоглобина кислородом от парциального давления кислорода рО2 имеет сигмоидную форму, что имеет важное физиологическое значение и позволяет молекуле гемоглобина реагировать на малые изменения давления кислорода, с освобождением или присоединением кислорда.
Взаимодействие кислорода с молекулой описывается в рамках аллостерической модели Моно – Уаймена – Шанжё, описывающей переход между двумя структурными состояниями.
Рис. 4. Аллостерические регуляторы влияют на равновесие между молекулами белка, в первую очередь, 2,3-дифосфоглицерат, Cl-.
Взаимодействие гемоглобина c О2 можно представить уравнением:
или в общем виде: 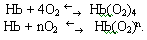
Cтепень насыщения гемоглобина с кислородом y представляется как отношение числа заполненных молекулами кислорода центров ν к общему числу центров Ν
y = ν / Ν.
В случае бесконечно высокой кооперативности связывания реакция протекает по принципу «все или ничего» (все центры либо свободны либо заняты). Для описания кооперативности процесса связывания вводят коэффициент кооперативности или коэффициент Хилла (Hill, 1910). Коэффициент Хилла n изменяется в пределах: 1≤ n ≤ Ν. Если n = Ν система ведет себя как идеально кооперативная, если n = 1, кооперативность отсутствует.
Коэффициент Хилла может быть получен экспериментально из наклона графика зависимости lg y /(1- y) от lg [О2], называемого графиком Хилла. Напомним, что y – степень насыщения белка лигандом, в нашем случае гемоглобина кислородом.
Хилл предложил свою модель для объяснения S-образных кривых связывания гемоглобином кислорода, уравнение Хилла выглядит следующим образом:
Lg y / (1- y ) = lg [О2] – lg К.
Точка пересечения графика Хилла с осью абсцисс дает величину – lg К, где К – константа диссоциации комплекса. В случае связывания гемоглобином кислорода коэффициент Хилла равен 2,8, в то время как молекула гемоглобина содержит 4 центра связывания.
Реактивы: эритроциты крысы, растворы хлорида натрия (0,15 М, 0.,01 М), раствор нитрита натрия NaNО2 (10-2 М).
Оборудование: Спектрофотометр СФ-46 (ЛОМО), автоматические пипетки объемом 10 – 100 мкл и 200 – 1000 мкл, пробирки, спектрофотометрические кюветы, весы аналитические
Ход работы
1. Приготовим изотонический раствор NaCl (0,15 МNaCl) и гипотонический гемолизирующий раствор NaCl (0,01 МNaCl).
2. Изолируем эритроциты, промывая изотоническим раствором NaCl.
3. Подвергнем эритроциты осмотическому гемолизу, внося упакованные клетки в гипотоническую среду (1 мл упакованных клеток + 20 мл гипотонической среды).
4. Центрифугируя, отделим раствор внутриклеточного гемоглобина от разрушенных мембран (15 тыс. оборотов/мин, 15 мин).
5. Приготовим раствор гемоглобина концентрации 3∙10-5 М, используя коэффициент экстинкции оксигемоглобина ε = 13700 М -1 см –1 на длине волны 341 нм в расчете на 1 моль гема.
6. Проведем реакцию окисления оксигемоглобина до метгемоглобина, внося в раствор оксигемоглобина раствор нитрита натрия NaNО2. Для этого приготовим 5 образцов раствора оксиНЬ (2 мл). К каждому образцу добавим соответствующее количество раствора NaNО2 (необходимо рассчитать), создавая концентрации:
1) 0; 2) 10-4 М; 3) 2 ∙ 10-4 М; 4) 5 ∙ 10-4 М; 5) 10-3 М;
исходный раствор NaNО2 – 10-2 М.
Механизм реакции взаимодействия оксиНЬ с нитритом хорошо известен. Предложено несколько схем, описывающих этот сложный процесс, включающий несколько стадий. Первичной реакцией может быть:
НЬО2(оксиНЬ) + NО2- → НЬ(III)(мет НЬ)+ NО2ׁ + Н2О2
Общая схема реакций может быть представлена следующим образом:
4НЬО2 + 4NО2- + 4Н+ → 4НЬ(III)+ 4NО3- + О2 + 2Н2О
Таким образом, нитрит окисляет оксиНЬ до метформы, вытесняя кислород. Следует обратить внимание, что нитрит является восстанавливающим агентом, сам при этом окисляется до нитрата NО3-.
7. После 10 мин. инкубации растворов оксиНЬ с нитритом (время, необходимое для завершения реакции), температура – 20 0С, определим содержание метформы НЬ по специфическому поглощению на длине волны 630 нм. Внесем полученные данные в следующую таблицу:
Зависимость количества образовавшегося метгемоглобина от концентрации нитрата натрия.
|
№ образца |
Концентрация NaNО2 |
Д630
|
Д630/ Д630макс (у) |
lg (y / 1-y) |
lg [NО2-] |
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
4 |
|
|
|
|
|
|
5 |
|
|
|
|
|
Построим два графика зависимостей:
1) по оси у отображаем величину Д630, по оси х отображаем концентрацию [NaNО2];
2) по оси у отображаем логарифм величины (y / 1- y), по оси х отображаем логарифм концентрации NО2.
Из последнего графика, который представляет график Хилла, определим коэффициент Хилла и кооперативность взаимодействия иона нитрита с оксиНЬ и «кажущуюся» константу диссоциации этого процесса. Поскольку согласно схеме реакции одна молекула нитрита вытесняет одну молекулу кислорода, можно предположить, что полученные значения отражают параметры взаимодействия гемоглобина с кислородом: кооперативность процесса оксигенации и сродство гемоглобина к кислороду.
