ЛАБОРАТОРНАЯ работа №24
Определение активности
2-ОКСОГЛУТАРАТДЕГИДРОГЕНАЗЫ
Реакции окислительного превращения 2-оксоглутарата с образованием сукцинил-КоА, углекислого газа, восстановленного НАД катализирует ферментная система, состоящая из 3 основных ферментов: собственно дегидрогеназа 2-оксоглутарата [E1] (КФ 1.2.4.2), липоатсукцинилтрансферазы[E2] (КФ 2.3.1.61) и липоамиддегидрогеназы[E3](КФ 1.6.4.3). Эти ферменты при участии КоА, НАД+, ФАД, Лип S2Н, ТДФ и Мg++ осуществляют последовательность реакций окислительного декарбоксилирования 2-оксоглутарата.
Суммарное уравнение имеет вид:
α -кетоглутарат + НАД+ +КоА-SH → сукцинил КоА + +СО2 + НАДН + Н+.
Локализованная в митохондриях ферментная система представляет собой высокоорганизованный комплекс функционально связанных ферментов. Значение этого комплекса в клеточном метаболизме обусловлено широким участием его субстратов и продуктов в обмене веществ. Важность их изучения не вызывает сомнений: во-первых, реакция окислительного декарбоксилирования 2-оксоглутарата локализирована в месте пересечения нескольких метаболических путей: 2-оксоглутарат является общим интермедиатом обмена углеводов и белков; во-вторых, ключевая роль оксоглутаратдегидрогеназного комплекса обусловлено тем, что он катализирует основной путь биодеградации оксокислоты.
Для изучения скорости окисления 2-оксоглутарата предложен ряд методов. Одни из них основаны на определении суммарной активности 2- оксоглутаратдегидрогеназного комплекса по скорости восстановления НАД или какого-либо искусственного акцептора электронов (2,6-дихлорфенолиндофенола, солей тетразолия, феррицианида и т.д.) Однако контроль активности комплекса по восстановлению НАД носит ограниченный характер, т.к. показано, что 2- оксоглутаратдегидрогеназа почек, печени быстро инактивируется из-за присутствия протеазы, вызывающей частичный протеолиз липоатсукцинилтрансферазы, что приводит к диссоциации ее первого и третьего компонентов. Подвергнутый ограниченному протеолизу комплекс утрачивает способность восстанавливать НАД.
В качестве одного из продуктов реакции окислительного превращения 2-оксоглутарата образуется углекислый газ. Реакция окислительного декарбоксилирования, катализируемая первым компонентом комплекса, является наиболее медленной из трех реакций и, следовательно, ограничивает скорость всего последующего процесса. Поэтому об активности энзима можно судить по количеству продукта декарбоксилирования 2-оксоглутарата – углекислого газа, связанного какой-либо щелочью. На этом принципе основан радиометрический метод тестирования активности 2-оксоглутаратдегидрогеназы.
Широко распространено определение активности 2-оксоглутаратдегидрогеназы методом, описанным Gubler, где в качестве искусственного акцептора электронов используется феррицианид калия. В процессе окисления субстрата происходит восстановление феррицианида, окраска последнего изменяется до бесцветной. Этот метод легко воспроизводим, доступны все реактивы, что также имеет немаловажное значение. Метод может быть использован для определения скорости окисления не только 2-оксоглутарата, но и пирувата.
Однако известен метод определения активности следующего митохондриального фермента цикла Кребса – суцинатдегидрогеназы с феррицианидом в качестве конечного акцептора электронов. Поэтому, чтобы исключить вклад суцинатдегидрогеназы в восстановление феррицианида, определение активности дегидрогеназы 2-оксоглутарата проводят в присутствии малоната в среде инкубации. Как известно, последний является конкурентным ингибитором энзима (СДГ).
Реактивы: 0,15 М Калий-фосфатный буфер рН 7,4; 0,2 М MnSO4 ; 0,02 М ЭДТА-динатриевая соль (трилон Б); 0,06 М АТФ – динатриевая соль; 0,0067 М K3[Fe (CN)6];0,05 М малонат калия,0,25 М сахароза, рН 7,4;0,4 М α -кетоглутарат, рН; 7,4,0,25 М сахароза, рН 7,4; суспензия митохондрий
Оборудование: Спектрофотометр СФ-46 (ЛОМО), автоматические пипетки объемом 10 – 100 мкл и 200 – 1000 мкл, пробирки, спектрофотометрические кюветы, весы аналитические
Ход работы
|
№ п/п |
Реактивы |
Инкубационная смесь (объем, мл) |
|
|
контроль |
опыт |
||
|
1.
2. 3.
4. 5. 6. 7. |
0,15 МКалий-фосфатный буфер рН 7,4 0,2 МMnSO4 0,02 МЭДТА-динатриевая соль (трилон Б) 0,06 МАТФ-динатриевая соль 0,0067 МK3[Fe (CN)6] 0,05 Ммалонат калия 0,25 Мсахароза, рН 7,4 |
0,5
0,1 0,1
0,1 0,7 0,1 1,6 |
0,5
0,1 0,1
0,1 0,7 0,1 1,6 |
|
8. 9. 10. |
0,4 Мα -кетоглутарат, рН 7,4 0,25 Мсахароза, рН 7,4 Суспензия митохондрий |
- 0,1 0,4 |
0,1 - 0,4 |
Инкубационную смесь разливают по 3,2 мл;0,4 Мраствор 2-оксоглутарата в количестве 0,1 мл вносят в опытные пробы. Контрольные пробы вместо субстрата содержат 0,1 мл0,25 Мраствора сахарозы.
Суспензию митохондрий готовят, добавляя 0,25 М раствор сахарозы к осадку митомондрий из расчета 4 мл на осадок из 1 гткани. Реакцию начинают прибавлением 0,4 мл суспензии митохондрий, которую вносят в заранее подготовленную среду инкубации. Пробы (контрольную и опытную) инкубируют в водяной бане при 25 0С 20 минут. Реакцию останавливают добавлением 0,3 мл 50 % ТХУ. Пробы центрифугируют 15 мин при3000 g и фотометрируют при длине волны 417 нм на спектрофотометре.
Разница между экстинкцией контроля (без субстрата) и опыта соответствует количеству восстановленной красной кровяной соли, что эквивалентно количеству окисленного 2-оксоглутарата в пробе. Количество восстановленного феррицианида определяли по калибровочной кривой и активности рассчитывают по формуле:
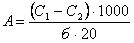
где С1 – содержание феррицианида (мкмоль) в контрольной пробе;
С2 - содержание феррицианида (мкмоль) в опытной прбе;
1000 – коэффицент перевода микромолей в наномоли;
б – содержание белка в пробе (в мг);
20 – время инкубации проб в мин.
Активность фермента выражают в наномолях K3[Fe (CN)6] на мг белка за 1 мин.
