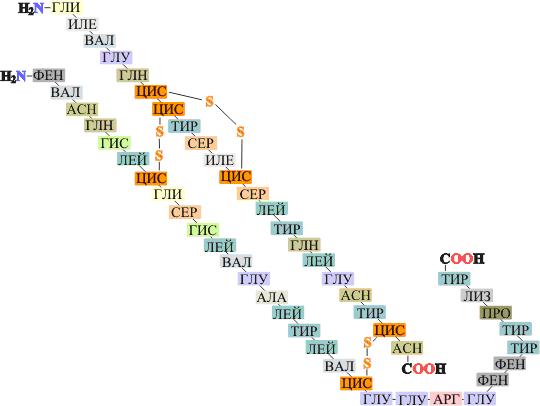
Аминокислотная последовательность инсулина
На расшифровку структуры инсулина было затрачено 10 лет (1944 – 1954 гг.).
В белки входят двадцать аминокислот, но в разных количествах и в разной последовательности. Именно последовательность аминокислот определяет трехмерную структуру белков и их функцию. С помощью гидролиза, разрывающего пептидные связи в молекуле белка, можно было найти соотношение аминокислот в ней, но как определить их последовательность, не было ясно до середины ХХ века. Эту задачу первым решил Фредерик Сенгер в 1955 г. Классическую работу он провел на молекуле инсулина – важного для медицины пептидного гормона, регулирующего содержание глюкозы в крови. Сенгер расщеплял инсулин разными протеиназами (ферментами, расщепляющими полипептидную цепь между определенными аминокислотными остатками) и получал несколько наборов коротких пептидов. В них он научился определять последовательность аминокислотных остатков, начиная с того, который был на конце цепочки (у него была свободная аминогруппа). Имея в своем распоряжении набор пептидов, Сенгер сумел определить, какие из них перекрываются, и восстановил исходную последовательность аминокислот в инсулине.