ПОГЛОЩЕНИЕ СВЕТА БИОСИСТЕМАМИ
Способность молекул поглощать свет лежит в основе спектрофотометрии, широко используемой в биологии и медицине для качественного и количественного анализа, для выяснения химической структуры и изучения химических реакций веществ. Поглощение света проявляется в ослаблении светового потока после прохождения через исследуемый объект, и оно тем больше, чем выше концентрация вещества (с, моль∙л–1), толщина раствора (1, см), способность вещества к поглощению. Для монохроматического света эти закономерности выражаются законом Бугера — Ламберта — Бера:
Д=lg∙I0/I = εcl,
где D — так называемая оптическая плотность образца, I0 и I — интенсивности падающего и прошедшего через раствор вещества света. Величину ε (моль–1· л· см–1) называют молярным коэффициентом экстинкции. Иногда используют параметр поперечное сечение поглощения s. Физический смысл s — эффективное сечение молекулы, при попадании в которое происходит поглощение фотона данной длины волны.
Графики, выражающие зависимости оптической плотности D, коэффициента молярной экстинкции ε или s от длины волны, называются спектрами поглощения.
Наиболее информативными параметрами спектров поглощения и излучения являются длина волны перехода (положение спектра на шкале длин волн), которая отражает разность энергий участвующих в переходах состояний, и интенсивность, которая пропорциональная квадрату индуцированного светом дипольного момента (момента перехода).
Электронные спектры поглощения возникают в результате переходов электронов в возбужденные состояния и наблюдаются в ультрафиолетовой, видимой и ближней инфракрасной областях (120 – 1000 нм). Энергии переходов составляют 1000 – 120 кДж/моль (240 – 30 ккал/моль). При поглощении такой энергии одновременно происходит изменение в колебательных и вращательных состояниях, вследствие чего электронные спектры состоят из широких полос.
Еще в позапрошлом столетии окраску веществ связывали с их строением, считая, что цвет соединения обусловливается наличием ненасыщенных химических группировок. В1876 г. Витт ввел для таких группировок термин «хроматофоры». Впоследствии понятие «хроматофоры» было распространено на группировки, поглощающие не только в видимой, но и в ультрафиолетовой области.
Для установления связи электронных спектров со строением органических соединений необходимо сделать отнесения полос поглощения к определенным электронным переходам. Теория электронных спектров основывается на квантово–механических представлениях, однако полное решение задачи в настоящее время невозможно и поэтому пользуются различными степенями приближения.
Наиболее широко применяется в этом случае метод молекулярных орбиталей, при котором предполагается, что для атомов, входящих в состав молекулы, внутренние электроны и электроны, не учавствующие в образовании связей, сохраняют ту же энергию, что и в индивидуальном атоме (находятся на атомных орбиталях). Валентные же электроны располагаются на новых энергетических уровнях, отличающихся от атомных. Эти уровни – молекулярные орбитали (МО) характеризуются своими волновыми функциями. Молекулярные орбитали образуются как линейные комбинации отдельных атомных орбиталей, и каждая молекула имеет набор МО со своими волновыми функциями. Квадрат волновой функции описывает вероятность нахождения электрона в данной точке пространства.
В органических соединениях поглощение в УФ и видимой областях связано с переходами валентных электронов одинарных и кратных связей (δ–и л–электроны) и электронов неподеленных пар гетероатомов (п– электроны).
Чем длиннее система сопряженных двойных связей в молекуле, т.е. чем сильнее делокализованы по молекуле л – электроны, тем при большей длине волны располагается самый длинноволновый максимум поглощения (рис. 10.).
Интенсивность полос поглощения определяется вероятностью перехода молекул из основного в возбужденное состояние. Спектр поглощения представляет зависимость вероятности поглощения от длины волны (или частоты) света.
Помимо величины оптической плотности Д вещества, используют величину пропускания Т=I/I0. Из определения оптической плотности видно, что Д=lg ∙1/Т.
Спектр поглощения вещества зависит от химической природы вещества, его состояния, характера окружения, температуры (рис. 10.). Химические превращения вещества, комплексообразование, изомеризация, изменение гидрофобности и т.д. – все это существенно сказывается на спектрах поглощения. Измерения электронных спектров поглощения позволяют делать заключение о характере исследуемого вещества, структуре и свойствах его молекул и т.д.
Если в исследуемом объеме находится несколько веществ (при отсутствии взаимодействия между ними), то для оптической плотности выполняется закон аддитивности для каждой длины волны:
ДАВ=ДА+ДВ,
где ДАВ –оптическая плотность смеси веществ А и В при данной длине волны.
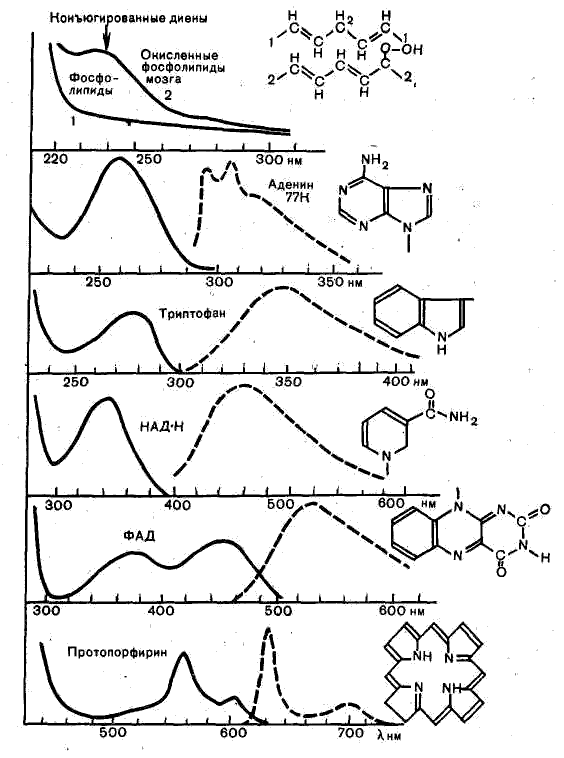
Рис. 10. Спектры поглощения и флуоресценции некоторых биологически важных соединений (структурные формулы хромофоров этих молекул приведены рядом со спектрами).
Сплошные кривые — оптическая плотность; точечные кривые — интенсивность флуоресценции.
