ЭЛЕКТРОННЫЕ ПЕРЕХОДЫ В БИОЛОГИЧЕСКИ ВАЖНЫХ МОЛЕКУЛАХ
Каждый электрон в молекуле находится на определенной орбитали и обладает определенной энергией. Таким образом, в молекуле существует система электронных энергетических уровней (рис. 8.). Для химических и оптических свойств молекулы наиболее важны два уровня: это верхняя (по энергии) заполненная молекулярная орбиталь (ВЗМО) и нижняя свободная молекулярная орбиталь (НСМО). Значение энергии ВЗМО определяет потенциал ионизации молекулы, а следовательно, способность отдавать электрон (донорные свойства). Потенциалом ионизации называют энергию, которую необходимо затратить, чтобы оторвать электрон от молекулы.
Чем выше энергия ВЗМО, тем ниже потенциал ионизации молекулы и тем лучший она донор электронов. Например, высоким значением энергии ВЗМО обладает витамин Е, который поэтому легко отдает электрон в реакциях со свободными радикалами, что и обусловливает его антиоксидантные свойства.

Рис. 8. Схема электронных молекулярных энергетических уровней и переноса электрона между двумя различными молекулами. Стрелками обозначены спины электронов.
Энергия НСМО определяет акцепторные свойства молекулы: чем ниже НСМО, тем охотнее данная молекула присоединяет электрон. Количественно акцепторные свойства характеризуются электронным сродством, которое равно количеству энергии, освобождающейся при перенесении свободного электрона из бесконечности на незанятую электронную орбиталь.
Окислительно–восстановительная реакция между донором и акцептором будет происходить, если энергия ВЗМО донора выше энергии НСМО акцептора (см. рис. 8.). Следует, однако, помнить, что перенос одного, а тем более двух электронов сопровождается перестройкой в молекуле (изменением энергии уровней, включая ВЗМО и НСМО). Поэтому редокс–потенциал не вполне точно коррелирует с донорно–акцепторными свойствами молекул.
На каждом заполненном энергетическом уровне могут находиться только два электрона, имеющие противоположные собственные магнитные моменты (спины). Если молекуле сообщить энергию, например, в форме кванта света, то произойдет переход одного электрона с заполненного уровня (обозначаемого в спектроскопии S0, рис. 9.) на один из незаполненных уровней. Молекула при этом оказывается в электронно–возбужденном состоянии. Уровни Sо, S1, S2,…., называются синглетными, при переходах между ними спин электрона не меняется. Время жизни молекул в состоянии S1 составляет 10–8 – 10–9с. Именно на уровне S1 решается дальнейшая судьба всех возбужденных молекул. С определенной вероятностью могут реализоваться следующие пути превращения энергии состояния S1:
1) в тепло: S1→ S0 ;
2) испускание кванта флуоресценции: S1→ S0 + h∙νфл;
3) фотохимическая реакция: S1→ продукт;
4) передача энергии возбуждения другой молекуле;
5) обращение спина электрона и переход молекулы в триплетное возбужденное состояние Т1: S1→ T1.
Переход из триплетного состояния в основное запрещен, так как спины электронов одинаковы. Поэтому в состоянии Т1 молекула находится значительно дольше (10–4 – 10 с), чем в S1 (10–8 – 10–9 с).
Существует несколько путей растраты энергии из триплетного (Т1) состояния молекулы:
1) безизлучательный переход в So с обращением спина: T1→S0;
2) испускание кванта фосфоресценции: T1→S 0+h∙ν;
3) фотохимическая реакция;
4) передача энергии возбуждения другой молекуле (см. рис. 9.).
Общее название для любых излучательных переходов в молекуле (флуоресценции, фосфоресценции) — люминесценция.
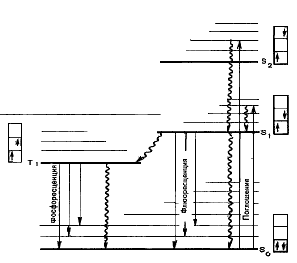
Рис. 9. Электронные переходы в биомолекулах
Прямые стрелки – поглощательные и излучательные переходы, волнистые – безизлучательные переходы. Жирные горизонтальные линии – «чисто» электронные уровни энергии; тонкие – колебательные подуровни. Около каждого уровня в клетках (соответствующих разным орбиталям) показано направление спина возбужденного электрона по отношению к спину оставшегося электрона.
