Лабораторная работа №58
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ЦИТРАТА
Одним из важнейших метаболитов цикла Кребса является лимонная кислота. Многообразие функций лимонной кислоты в клетке привлекает внимание исследователей к изучению этого компонента ЦТК. Лимонная кислота образуется путем конденсации ацетил–кофермента А и оксалоацетата в митохондриях. Реакция образования лимонной кислоты является основным путем ввода углеродных радикалов (двууглеродных и четырехуглеродных) в цикл трикарбоновых кислот. Значительная часть цитрата в клетках сосредоточена в митохондриях, и лишь около 10 % от общего количества цитрата в клетке находится в цитоплазме, куда она проникает с помощью специального переносчика. В митохондриях лимонная кислота в основном участвует в энергетическом обмене.
Лимонная кислота принимает участие во многих регуляторных процессах. Например, цитрат выступает в клетке в качестве активного регуляторного агента, осуществляющего эти функции как аллостерический эффектор. Сказанное выше хорошо иллюстрируется тем, что от изменения уровня цитрата зависит активность фосфофруктокиназы, пируватдегидрогеназы, малатдегидрогеназы.
Еще одной возможностью проявления регуляторной роли цитрата является влияние его на ацетил–КоА–карбоксилазу – фермент, катализирующий первую ступень биосинтеза жирных кислот, а также действие цитрата на ацил–КоА–синтетазу – фермент, активирующий карбоксильные группы жирных кислот путем образования ацилов–КоА. Стимулирующий эффект цитрата на ацетил–КоА–карбоксилазу обусловлен смещением равновесия от неактивной к каталитически активной форме фермента, а также индуцированием конформационных изменений вблизи биотиновой простетической группы.
Для ацил–КоА–синтетазы цитрат служит ингибитором, следовательно, чем меньше концентрация цитрата в клетке, тем интенсивнее будет протекать окисление жирных кислот. Таким образом, концентрация лимонной кислоты регулирует соотношение скоростей процессов липогенеза и липолиза.
Для определения количества цитрата предложен ряд энзиматических и колориметрических методов. В основу данного определения положен метод Нательсона с соавторами.
В основе метода лежит реакция бромирования лимонной кислоты в присутствии ионов марганца с образованием пентабромацетона. Последний образует окрашенный комплекс с тиомочевиной, интенсивность желтой окраски этого соединения пропорциональна количеству лимонной кислоты в пробе.
Тиомочевина и ее производные (этилтиомочевина, ацетилтиомочевина, аллилтиомочевина) в сильно щелочной среде образуют с пентабромацетоном комплексное соединение желтой окраски, которая медленно исчезает при комнатной температуре.
Для количественного определения лимонной кислоты необходимо, чтобы значение рН среды было в пределах 9,0 – 9,2, при этом образуется продукт, характеризующийся постоянным коэффициентом экстинкции и максимумом поглощения при длине волны 430 нм. Такую величину рН имеет 4 % раствор тиомочевины в 2 % растворе буры.
Реактивы:
1)10 % ССl3 СООН;
2) Бромный реактив (11,002 гКВr растворяется в 100 мл бромной воды);
3) 5 % КМnО4;
4) 3 % и 6 % Н2О2;
5) 18 нН2SO4;
6) раствор тиомочевины (в 100 мл этого раствора содержится4,0 гтиомочевины и2,0 гбуры), рН 9,0 – 9,2;
7) петролейный эфир (петролейный эфир очищали концентрированной Н2SO4 до прекращения образования темноокрашенных продуктов, далее его промывали 0,5 % раствором КМnО4 , приготовленным на 0,5 н Н2SO4, сушили над плавленым СаСl2 и перегоняли). Для определения цитрата использовали фракцию, полученную при температуре 90 0 – 100 0С;
8) стандартный раствор лимонной кислоты (48 мг лимонной кислоты, высушенной до постоянной температуры или 52,5 мг гидрата лимонной кислоты (одноводной) растворяли в 25 мл 1 н Н2SO4, непосредственно перед использованием его разводили в 100 раз, т.е. 1 мл стандартного «рабочего» раствора содержит 19,2 мкг (0,1 мкмоля) лимонной кислоты).
Оборудование: Спектрофотометр СФ–46 (ЛОМО), автоматические пипетки объемом 10 – 100 мкл и 200 – 1000 мкл, пробирки, спектрофотометрические кюветы, термостат.
Ход работы
Навеску замороженной и тщательно растертой ткани в количестве 0,4 – 0,5 г. помещали в центрифужную пробирку, куда предварительно наливали 3,0 мл 10 % ТХУ, затем 10 % ТХУ доводили объемом смеси до 9–кратного по отношению к навеске ткани. Пробирки взбалтывали или перемешивали стеклянными палочками для лучшей экстракции лимонной кислоты, после чего пробы центрифугировали в течение 10 – 15 мин при 3000 об/мин. На определение лимонной кислоты брали 3,0 мл центрифугата, который помещали в специальные конические пробирки с притертой пробкой и меткой на уровне 0,4 мл. К пробам добавляли 2 капли 18 нН2SO4 и выпаривали до объема 0,4 мл на хлоркальциевой бане, температуру которой регулировали в пределах 105 0 – 107 0С. После охлаждения к пробам прибавляли по 2,0 капли бромного реактива, а через 10 мин – 0,2 мл 5 % КМnО4. пробы перемешивали и оставляли на 10 мин при комнатной температуре, после чего их охлаждали в ледяной бане в течении 10 мин. Далее избыток раствора перманганата калия удаляли охлажденным 6 %–м раствором Н2О2. Поскольку избыток перекиси водорода завышает результаты, реактив добавляли по каплям, энергично встряхивая пробу, затем для обесцвечивания раствора в конце использовали 3 %–й раствор Н2О2.
Экстракцию образовавшегося пентабромацетона проводили петролейным эфиром. К образцам приливали 1,4 мл петролейного эфира, закрывали притертыми пробками и энергично встряхивали в течение 3 минут.
Для проведения цветной реакции отбирали 1,0 мл петролейно–эфирного экстракта и переносили в пробирку с притертой пробкой, куда предварительно наливали 3,5 мл раствора тиомочевины с бурой. Пробу энергично встряхивали в течение 3 мин и для лучшего разделения фаз центрифугировали 5 мин при3000 g.
Нижний водный слой, окрашенный в светло–желтый цвет, осторожно отсасывали с помощью пипетки Пастера с оттянутым кончиком. Интенсивность окраски измеряли на спектрофотометре при длине волны 430 нм. Фотометрирование проводили против контроля, для получения которого на выпаривание брали вместо безбелкового фильтрата 3,0 мл 10 % раствора ТХУ и обрабатывали как образцы.
Для расчета количества лимонной кислоты в пробах применяли калибровочную кривую, построенную по результатам спектрофотометрирования проб, содержащих от 0,05 мкм до 0,25 мкмолей (от 0,5 до 2,5 мл стандартного рабочего раствора).
Расчет количественного содержания лимонной кислоты в тканях производится по формуле:
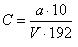 ,
,
где C – содержания лимонной кислоты в мкмолях / г ткани;
V – объем ТХУ–экстракта, взятый на определение (3 мл);
а – количество цитрата в пробе, определенное по калибровочной кривой в мкг;
192 – молекулярная масса лимонной кислоты.
